Химикам удалось «поломать природу»: синтезировано соединение, в котором четырехкоординированный атом углерода плоский, а не тетра-эдрический в соответствии с теорией гибридизации.
Почему углерод?
Если в поисковой системе научных публикаций PubMed, в строке поиска, набирать названия химических элементов таблицы Менделеева, то лидировать по частоте употребления в научной литературе будут всего три слова: водород, углерод и кислород. С небольшим отставанием следует азот. Именно из этих элементов в основе своей состоят органические вещества — все живое и «бывшее живое» на Земле (нефть тоже состоит из органических веществ). Такое многообразие органических соединений объясняется уникальными свойствами одного элемента — углерода. Его атомы способны образовывать разнообразные связи друг с другом, создавая разветвленные цепочки неограниченной длины (существованием полимеров мы тоже обязаны углероду).
Чем объясняется эта способность? Долгое время химики не могли разработать сколь бы то ни было разумную теорию строения органических соединений. Одним из первых кирпичиков такой теории стала гениальная догадка лауреата Нобелевской премии голландца Якоба Вант-Гоффа.
В 1874 г. он высказал предположение, что координация атома углерода не является плоской, химические связи между ним и его соседями направлены по ребрам правильного тетраэдра.
Со времен Вант-Гоффа каждый человек, прослушавший курс органической химии в старших классах средней школы, помнит, что углерод в sp3-гибридном состоянии тетраэдри-ческий (простейший пример — молекула метана). То есть плоская координация углерода, конечно, существует, но в sp2-гибридном состоянии и, соответственно, образует он три связи: одну двойную и две одинарные.
Вант-Гофф пришел к идее такого пространственного строение органических соединений, исследуя явление оптической изомерии. Если все четыре заместителя при атоме углерода различны, то такую систему нельзя совместить с ее зеркальным отражением. Такие молекулы как наши руки, а явление получило название хиральности («хиро» по-гречески «рука»).
Задача Вант-Гоффа не была праздной: многие биологические активные молекулы хи-ральны. Хиральны аминокислоты, из которых состоят белки и ферменты, хиральны углеводы. И вот незадача: в биологических системах оптические изомеры аминокислот и углеводов не перемешаны, а строго оптически чисты.
Большинство аминокислот в нас существует в виде L-изомеров (левых), а сахара, напротив в виде D-изомеров (правых). Это явление известно в биологии как гомохиральность («гомос» по-гречески «одинаковый»).
Иногда разделение оптических изомеров и вовсе невозможно: изомеры печально известного талидомида вообще свободно переходят один в другой в человеческом организме. В конце 50-х годов беспечное отношение фармацевтов к проблеме оптической изомерии органических соединений привело к рождению до 50 тысяч детей с врожденными физическими нарушениями (история препарата талидомид описана в романе Артура Хейли «Сильнодействующее лекарство»).
Хиральность играет большую роль в функционировании нашего организма. Ферменты используют хиральность для распознавания субстрата (вещества, с которым должна протекать реакция). Предположим, что у энзима впадина, в которой происходит связывание субстрата, имеет форму перчатки для правой руки. Тогда «левый» оптический изомер субстрата не сможет туда попасть или будет связываться очень плохо. Этот механизм обеспечивает селективность (избирательность) ферментативных реакций. Аналогичен механизм распознавания рецепторами вкуса различных оптических изомеров. D-форма аминокислот обычно сладкая на вкус, а L-форма вкуса не имеет. Листья перечной мяты и семена тмина содержат L-карвон и D-карвон соответственно, но пахнут по-разному. Причина в том, что рецепторы содержат хиральные молекулы, по-разному реагирующие на разные изомеры.
Как произошло разделение оптических изомеров при зарождении жизни? Обычно при реакциях с образованием хиральных молекул в отсутствие внешних факторов (например, оптически активного растворителя) образуется так называемая рацемическая смесь, в которой оптические изомеры присутствуют примерно в равных количествах. Ситуацию удается исправить, лишь используя хиральные растворители, хиральные сорбенты в хроматографии либо асимметризующий активный реагент. Спонтанно разделение оптических изомеров не происходит.
Официальная точка зрения: выбор хиральности в жизни на Земле был чисто случайным. Фантасты с подачи ученых вполне развили тему «зеркальной жизни». Ну а для альтернативной науки эта проблема открывает самые широкие горизонты, вплоть до подтверждения сотворения жизни на Земле некой высшей силой. Так или иначе, все механизмы работы и предположения касаются именно тетраэдрического углерода. Тем важнее и интереснее теоретическая и синтетическая задача его «сплющивания».
Химическая логика подсказывала, что изменение тетраэдрической геометрии доступнее всего в напряженных циклических соединениях. Так, тетраэдрический углерод в циклопропане весьма сильно отличается от идеального. Углы ССС равны, как и полагается в правильном треугольнике, 60°, а углы НСН — 114-115°. Даже одинарные ковалентные связи, свойственные алканам и циклоалканам, изгибаются и становятся «банановыми». Так возникла гипотеза стабилизации плоского углерода в «окнах» — фенестранах (fenestre (лат.) — «окно»). Центральный атом углерода в таких соединениях был бы связан с четырьмя атомами углерода и входил одновременно во все четыре цикла. Первый фенестран был синтезирован в 1972 г. (Georgian, V.; Saltzman, M. Tetrahedron Lett. 1972, 4315.): число атомов углерода в «окошках» было 4, 5, 5 и 6. Однако все попытки стабилизировать плоский углерод в фенестранах ни к чему не привели.
Тогда химики решили «гнуть» углерод с помощью электронных эффектов. В 70-е годы прошлого века Пауль фон Шлейер рассчитал потенциально возможное соединение, в котором заместители — щелочные металлы — стабилизируют плоский углерод. Молекула H2CLi2 просто обязана была стать плоской, но получить ее синтетически, опять же, не удалось.
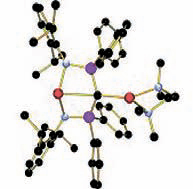
И вот столетняя загадка разрешена: группе Стивена Лиддла из Ноттингемского университета удалось синтезировать литий-органическое соединение, в котором углы связей при плоском четырехкоординированном углероде составляют почти 90°. Работа опубликована в Angewandte Chemie (http://dx.doi.org/10.1002/anie.201002483).
В полученном комплексе атом углерода находится в окружении двух атомов лития и двух атомов фосфора. Использование бидентатного (координирующегося с атомом металла сразу в двух точках) амина в качестве лиганда позволило увеличить основность литиевого основания и стабилизировать необходимую конформацию.
Лиддл признает, что использовал идею Шлеера. В работе утверждается, что синтез и исследование соединения с транспланарным четырехкоординированным атомом углерода проведено максимально аккуратно и точно. В таких соединениях геометрические параметры — межатомные расстояния — не являются достаточно достоверными. В дополнение к рентгеноструктурному исследованию комплекса были проведены квантовохимические расчеты, подтверждающие наличие перекрывания между орбиталями атома углерода и обоих атомов лития.
Александра Борисова