Международный союз чистой и прикладной химии (IUPAC), которому принадлежит право оформлять «язык» в химии (в частности, согласовывать название новых элементов, например), решил изменить и уточнить определение водородной связи — самого прочного из так называемых «невалентных» взаимодействий, т.е. химических контактов, которые нельзя изобразить традиционной «палочкой» между двумя атомами.
Предыдущее определение водородной связи было внесено в «Золотую книгу» IUPAC — библию химической номенклатуры — в 1997 г. и не слишком отличалось от терминологии, предложенной Лайнусом Полингом еще в 1931 г. в одной из его основополагающих работ — «Природа химической связи».
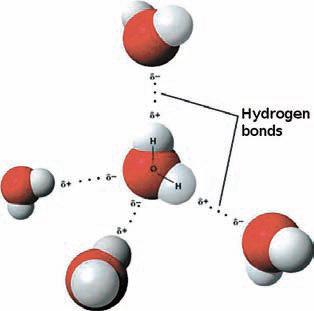
Катион водорода — это протон, так как, формально, он не содержит ни одного электрона. Единственный его электрон участвует в образовании простой (одинарной) связи с неводородным атомом. Ряд неметаллов — углерод, азот, кислород и другие — имеет более высокую электроотрицательность, чем водород, и при формировании связи «оттягивают» на себя электрон с него. Самой распространенной является связь углерод-водород: она встречается во всех без исключения органических соединениях, из которых состоит весь живой мир. Однако в дополнение к ковалентной связи атом водорода может участвовать в так называемой водородной связи, в которой кроме донора протона — ковалентно связанного с ним неводородного атома — участвует акцептор протона — обычно атом неметалла с неподеленной электронной парой. Чаще всего в качестве акцептора протона выступает кислород или азот, хотя это могут быть и сера, и галогены. Такие связи значительно слабее, их энергия редко превышает несколько десятков килокалорий на моль, однако они играют большую роль в природе.
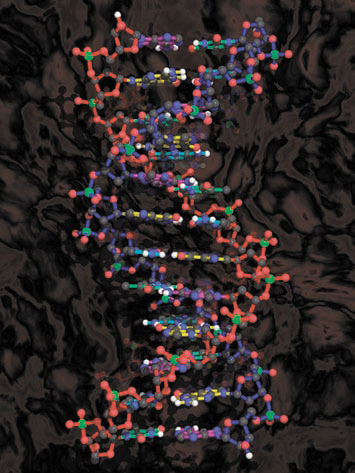
Именно водородные связи формируют вторичную структуру белка. Пептидная связь содержит как донор протона (NH-группа), так и акцептор протона — кислород карбонильной группы. Водородными связями связаны комплементарные основания ДНК, т.е. сформирована ее двойная спираль. Водородные связи образуются в любых системах, где есть потенциальные донор и акцептор протона. Ассоциация молекул воды и спиртов с помощью водородных связей обеспечивает важные физические свойства — теплоемкость и теплопроводность. Несмотря на небольшую энергию каждой из связей, суммарный эффект их достаточно серьезный: они повышают температуру кипения, вязкость и поверхностное натяжение жидкостей.
Однако в последнее время в химии было открыто много неклассических водородных связей, которые уже не удовлетворяли классическому определению Полинга, — обнаружены диводородные связи, неклассические доноры и акцепторы протонов. В связи с этим профессор Гаутам Дезиражу из Индии, признанный классик супрамолекулярной химии, выступил в IUPAC с предложением изменить «устаревшее» определение с тем, чтобы включить в него понятия о «новых» водородных связях.
На данный момент определение IUPAC (базовая часть) звучит следующим образом: водородная связь — это форма ассоциации между электроотрицательным и водородным атомом, соединенным со вторым относительно электроотрицательным атомом. Таким образом, это электростатическое взаимодействие, существующее между двумя диполями, разделенными небольшим атомом водорода.
Предлагаемое определение более широкое: водородная связи — это связывающее (аттрактивное) взаимодействие между атомом водорода молекулы или фрагмента X-H, где X — более электроотрицательный, чем H, и атомом или группой атомов этой или другой молекулы. Таким образом, на акцептор протона не накладывается серьезных ограничений — должно быть лишь некое подтверждение существования взаимодействия частично ковалентного типа.
Раньше водородными связями считался узкий круг взаимодействий с энергией не более 5-6 ккал/моль. Сейчас мы знаем, что их энергия колеблется в интервале 0,5-40 ккал/моль. Самые сильные водородные связи — F-H…F, самые слабые — ненаправленные C-H…O взаимодействия.
«В последние 10 лет и экспериментальные методы, и теоретические вычислительные подходы значительно улучшились, и мы можем на количественном уровне изучать даже самые слабые неклассические водородные связи», — подчеркнул профессор Дезиражу. Действительно, в области теоретических подходов разработаны расчетные (computational) методы, которые позволяют качественно учитывать даже самые слабые взаимодействия. Экспериментальные методы (рентгенодифракционные и нейтро-нографические исследования, ЯМР-спектроскопия) позволяют в ряде случае определить не только позиции донора и акцептора протона, но и локализовать сам атом водорода, а также изучить электронную структуру таких систем.
Водородная связь — пример четырехэлектронной трехцентровой связи. По одному электрону предоставляют донор протона и протон, а неподе-ленную электронную пару — акцептор протона. Таким образом, это уже не чисто электростатическое взаимодействие, большую роль играет обобществление электронов.
Сейчас возможность введения нового определения обсуждают специалисты. В марте дискуссии закончатся, и, как надеется профессор Дезиражу, новое определение появится в «Золотой книге» IUPAC.
>По одному электрону предоставляют донор протона и протон
Протон предоставляет электрон. При этом он, наверное, превращается в нейтрон и нейтрино.
Предпоследний абзац — сапогивсмятку.