В массовом сознании ядерная физика ассоциируется с чем-то опасным и уж во всяком случае вредным для здоровья. Увы, такая точка зрения не лишена оснований. Однако, будучи применяемой с умом и ответственностью, ядерная физика (помимо прочей пользы) способна оказать ощутимую помощь медицине, в том числе в борьбе с таким тяжелым недугом, как рак.
Особо подчеркнем, что в медицине находит применение практически весь арсенал концепций, результатов и методов ядерной физики: радиоактивность, ядерные реакции, взаимопревращения элементарных частиц, ускорители, детекторы. Благодаря высокой квалификации отечественных ядерщиков наша страна вполне может стать одним из мировых лидеров в соответствующих областях.
1. Если препарат, содержащий гамма-излучающий радионуклид, имеет тенденцию накапливаться в том или ином органе, то регистрация испускаемых гамма-квантов позволяет визуализировать этот орган и его физиологическую активность, не нарушая целостности организма. Простейшим примером может служить использование йода-131 (период полураспада — около 8 суток). Введенный пациенту радиоактивный йод имеет тенденцию накапливаться в щитовидной железе (содержащей около 20% всего йода организма человека). Еще в предвоенные годы таким методом измерялась ее физиологическая активность [1].
2. С появлением сцинтилляционных детекторов излучения (более чувствительных по сравнению со счетчиками Гейгера) были созданы специальные сканеры, позволяющие получать изображения щитовидной железы, на которых видны участки повышенной и пониженной физиологической активности. Их наличие позволяет заподозрить патологические изменения. В последние десятилетия на смену сканерам пришли позиционно-чувствительные гамма-камеры.
3. В настоящее время в ядерной диагностике широко используются фармпрепараты, содержащие технеций-99m — долгоживущее (период полураспада — около 6 часов) изомерное состояние технеция-99. Одно из преимуществ этого нуклида состоит том, что он является почти чистым гамма-излучателем (период полураспада основного состояния технеция-99 составляет около 2105 лет, поэтому суммарная активность в организме пациента будет намного меньше активности введенного технеция-99m). В свою очередь технеций-99m образуется в результате распада молибдена-99 (период полураспада — 66,7 часа). На американском жаргоне генераторы технеция-99m называют «молибденовыми коровами», а получение конечного продукта — дойкой [2].
4. Гамма-камера позволяет получить лишь проекцию распределения радионуклида в организме на заданную плоскость. Но оказывается, что регистрация фотонов, вылетающих во всех направлениях, позволяет после соответствующей обработки данных восстановить трехмерное распределение радионуклида в теле пациента. Эта методика носит название одно-фотонной эмиссионной компьютерной томографии (ОФЭКТ, англ. SPECT).
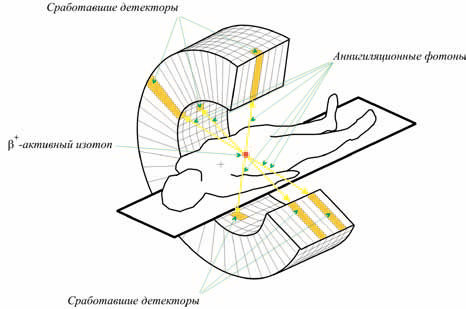
5. Некоторые радиоактивные ядра при распаде испускают позитроны. Такой позитрон быстро тормозится в веществе и аннигилирует с одним из электронов среды, образуя два гамма-кванта, разлетающихся в противоположных направлениях (рис. 1). Поэтому одновременное срабатывание двух из окружающих пациента детекторов будет означать, что распавшееся радиоактивное ядро находилось на линии, соединяющей эти два детектора. Эта основанная на методе совпадений (разработанном в физике космических лучей) диагностическая методика носит название позитронно-эмиссионной томографии (ПЭТ, англ. PET). Радионуклиды, испускающие позитроны, имеют, как правило, короткое время жизни (например, период полураспада фтора-18 составляет 109,7 минуты). Поэтому такие нуклиды нарабатываются на циклотроне, установленном непосредственно в клинике, там же они извлекаются из облученной мишени и вводятся в состав химического соединения, активно участвующего в обмене веществ в организме (например, фтордеоксиглюкозы).

6. Ядерные излучения широко используются не только для диагностики, но и для терапии ряда заболеваний, и прежде всего злокачественных опухолей. В основе лучевой терапии лежит повышенная чувствительность раковых клеток к ионизирующему излучению. Исторически первой стала применяться терапия жесткими фотонами — рентгеновскими и гамма-квантами. Однако высокая проникающая способность гамма-излучения приводит к тому, что значительному облучению подвергаются также и здоровые ткани. Примерно к такому же результату будет приводить и облучение пучком электронов.
7. Обнадеживающие результаты показывает терапия быстрыми нейтронами. Нейтроны не являются непосредственно ионизирующими частицами, однако они могут рассеиваться на ядрах, передавая им энергию и импульс отдачи, а также вызывать ядерные реакции. Ядра отдачи и продукты реакций создают в веществе высокую плотность ионизации вблизи своих траекторий, что приводит к разрушению тех разновидностей опухолевых клеток, которые обладают повышенной устойчивостью к слабо-ионизирующим фотонному и электронному излучениям.
8. Можно создать фармпрепарат, способный избирательно накапливаться в опухоли и содержащий стабильный изотоп бора-10, обладающий большим сечением резонансного захвата тепловых нейтронов. В результате реакции образуются ядра лития-7 и гелия-4, пробег которых составляет порядка 10 микрон. Таким образом, поражаться будет именно та клетка, которая содержала атом бора. Такая бор-нейтрон-захватная терапия (БНЗТ) в сочетании с хирургическим лечением показала обнадеживающие результаты. Одной из проблем, стоящих на пути широкого внедрения метода, является необходимость создания компактного и недорогого источника надтепловых нейтронов. Такие нейтроны, тормозясь в организме, достигали бы тепловых скоростей на глубине залегания опухоли, что позволило бы избежать хирургического вмешательства [3-5].
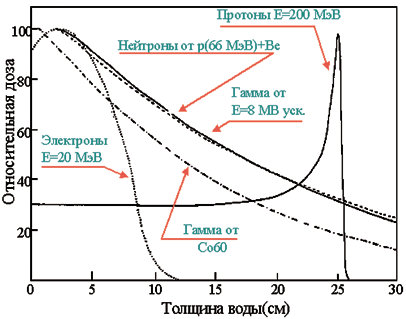
9. Огромным потенциалом обладает терапия пучком тяжелых заряженных частиц — протонов или легких ядер. Преимущество этого метода заключается не только в высокой плотности ионизации среды вблизи траекторий частиц. Известно, что максимум ионизационного торможения заряженная частица испытывает на последних миллиметрах своего пробега, перед остановкой (соответствующий максимум на кривой ионизационных потерь носит название брэгговского пика, рис. 3, 4). Это позволяет, подбирая соответствующим образом энергию пучка, локализовать выделение энергии частицами непосредственно в опухоли [6-10]. Дополнительного уменьшения дозовой нагрузки на окружающие здоровые ткани можно добиться, облучая опухоль несколькими пучками с разных направлений. Это особенно важно в тех случаях, когда опухоль непосредственно примыкает к жизненно важным органам.
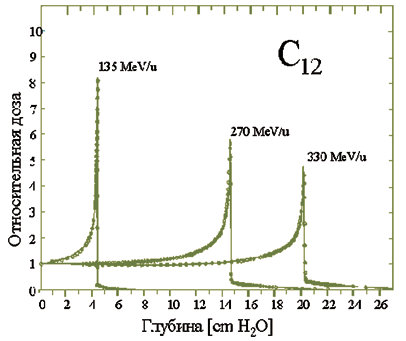
10. Использование вместо пучка протонов пучка ядер углерода-12 обладает несколькими дополнительными преимуществами [10]. Более высокая плотность ионизации в треке позволяет лучше справляться с резистентными опухолями. Большая высота брэгговского пика по отношению к ионизации во входном канале позволяет уменьшить общую дозу облучения. Большая масса частиц уменьшает поперечное размытие пучка за счет многократного рассеяния. Часть ядер пучка превращается в нестабильные ядра углерода-11, распадающиеся с испускание позитронов, что позволяет оперативно контролировать качество проведенной терапии с помощью позитронно-эмиссионной томографии.
11. Наиболее экзотической идеей является использование для терапии опухолей пучка отрицательно заряженных пи-мезонов. Остановившийся в веществе отрицательный пион захватывается атомным ядром и вызывает его распад на несколько фрагментов с малым пробегом и большой удельной ионизацией (на жаргоне экспериментаторов, «дает звезду»), что позволяет эффективно «выжигать» опухоли [7]. Однако из-за отсутствия подходящих пучков пи-мезонов этот метод пока не нашел клинического применения.
Владислав Сыщенко,
докт. физ-мат. наук,
Белгородский государственный
национальный исследовательский университет
1. Франк Г.М. Применение искусственно-радиоактивных веществ в биологии и медицине // УФН 25 (1941), 179-189.
2. Hendee W.R., Ritenour E.R. Medical Imaging Physics. — Wilew-Liss, New York, 2002. — Р. 37.
3. www.bnct.ru
4. www.computerra.ru/science/532140
5. www.computerra.ru/science/532948
6. Лоуренс Дж. и др. Тяжелые частицы и Брегговский пик для лучевой терапии // УФН 92 (1967) 527-533.
7. Гольдин Л.Л. и др. Применение тяжелых заряженных частиц высокой энергии в медицине // УФН 110 (1973), 77-99.
8. Флеров Г.Н., Барашенков В.С. Практические применения пучков тяжелых ионов // УФН 114 (1974), 351-373.
9. Кравчук Л.В. Развитие ядерно-физической медицины в Институте ядерных исследований РАН // УФН 180 (2010), 665-670.
Здесь корректнее говорить медицинская физика, как один профилей физики именно для медицины. У нас в вузе, ядерной физикой занимаются подготовкой для нии атомных реакторов, а вот медфизиков готовим для работы в радиологическом и онко центре или диспансере))))
Когда-то мы были вполне на уровне по протонам. В ИТЭФе работала установка. Потом настали годы запустения. И только сейчас наконец восстановили протоны в Протвино и Обнинске. Об углероде и задача не стоит, хотя в мире уже десятки таких установок.