1. Прионы — это, по определению, данному Стенли Прузинером (Stanley B. Prusiner), инфекционные белки. Он же придумал название: infectious protein → (proin) → prion. Соответственно, в отличие от всех прочих инфекционных агентов, прионы не содержат какой-либо генетической программы в виде ДНК или РНК. Первым изученным прионом был белок PrP млекопитающих, с которым связаны такие болезни, как скрейпи овец, недавнее «коровье бешенство», болезнь каннибалов куру и болезнь Крейцфельдта — Якоба.
2. PrP пока остается единственным известным при-оном животных, зато около десятка прионов было обнаружено у дрожжей и грибов. Правда, прионы дрожжей в природе не передаются горизонтально, между отдельными клетками. Они передаются лишь при скрещивании и проявляют себя как наследуемые признаки с нестандартными, не-менделевскими свойствами. Прионная инфекция плохо передается между разными видами организмов, даже близкородственными. Прионы дрожжей совершенно безопасны для человека.
3. Прионные белки имеют две формы, инфекционную и нормальную. В основе инфекционности прионов лежит автокаталитический процесс: инфекционная форма прионного белка изменяет нормальную форму, превращая ее в подобие себя. Большинство прионов принадлежит к амилоидному типу (см. ниже). Однако белковая инфекция или наследственность может использовать и иные механизмы. Например, дрожжевой прион р представляет собой протеазу Prb1, которая активирует другие молекулы Prb1, удаляя у них блокирующий аминоконцевой пептид.
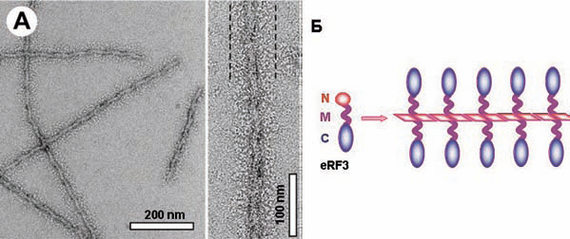
4. Амилоид — это нитевидный белковый агрегат, способный катализировать присоединение к себе мономерных молекул того же белка, сопряженное с их глубокой структурной перестройкой. Его также можно рассматривать как одномерный кристалл, в отличие от привычных всем трехмерных кристаллов. Во многих случаях, например у дрожжевых прионов, в амилоидном превращении участвует лишь малая часть белковой молекулы, которая образует стержень амилоида. Оставшаяся часть молекулы «висит» на этом стержне в неизменном виде (рисунок 1).
5. Амилоидогенные белки в норме растворимы (мономерны). Их превращение в амилоид является причиной более 30 болезней человека, например болезней Альцгеймера и Паркинсона. Эти болезни обычно появляются в зрелом возрасте. Они неинфекционны, кроме случая PrP. Все они пока не излечимы.
6. Четвертичная структура амилоида одновременно является вторичной, поскольку амилоид представляет собой единый мультимолекулярный P-лист. Чтобы представить эту структуру, возьмем много белковых молекул, вытянем каждую в линию и сложим их параллельно на плоскости, так, чтобы аминокислоты с одинаковыми номерами были рядом. Это — р-лист, в котором соседние полипептидные цепи скреплены множеством водородных связей. Наконец, сложим этот лист гармошкой, чтобы складки шли перпендикулярно пептидам, параллельно оси амилоида (рисунок 2). Благодаря обширным водородным связям амилоиды весьма прочны, по удельной прочности на разрыв сравниваясь со сталью. Амилоиды также устойчивы к протеазам, что вызывает их накопление в тканях и отложение в виде бляшек.
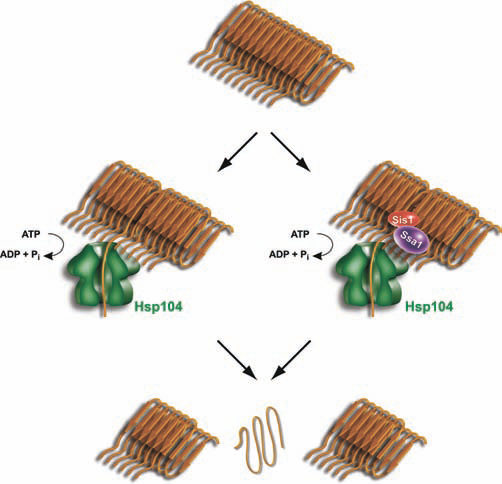
7. Ключевую роль в размножении прионов дрожжей играет молекулярная машина Hsp104, которая дробит прионные нити на более короткие фрагменты, выдергивая из нитей отдельные белковые молекулы. Эти мелкие фрагменты растут так же хорошо, как и большие, и обладают даже большей инфекционностью. Вероятно, главное отличие прионов и неинфекционных амилоидов состоит в повышенной подверженности прионов фрагментации. Интересно отметить, что номинально действие Hsp104 направлено на разборку и уничтожение всяческих агрегатов, однако без него дрожжевые прионы не поддерживаются и быстро исчезают из растущей культуры дрожжей. Гомолог Hsp104 у животных и человека отсутствует, но аналогичная активность, видимо, существует.
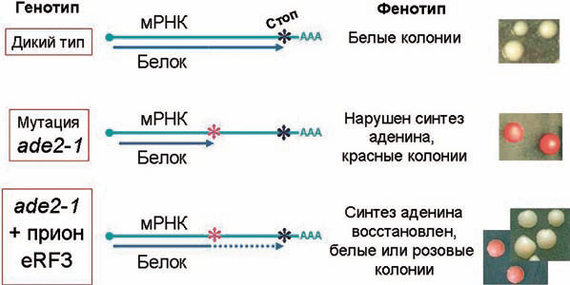
8. У дрожжей прионное состояние фактора терминации трансляции eRF3 (также известное как детерминант [PSI*]) позволяет супрессировать нонсенс-мутации. Это мутации, создающие стоп-кодоны внутри белок-кодирующих областей, что определяет преждевременное завершение синтеза соответствующего белка. В прионном состоянии белок eRF3 малоактивен, что позволяет проскочить стоп-кодон и синтезировать белок полностью (рисунок 3).
9. Прион Het-s нитчатого гриба Podospora anserina контролирует репродуктивную «мораль», запуская самоуничтожение у некоторых гибридов от скрещивания. Дилемма в том, что скрещивание позволяет получить новые варианты генов, что важно для эволюции, но несет опасность получения вирусов, способных убить всю популяцию. Прион делит популяцию гриба на две части, одна из которых открыта для обмена генами, а другая полузакрыта для сохранения вида в случае распространения вирусов.
10. Некоторые амилоиды животных имеют полезные и важные функции. У дрозофилы переход в амилоидное состояние белка Orb2 является ключевым событием в механизме долговременной памяти. Не исключено, что память человека тоже основана на амилоидном превращении.
Виталий Кушниров,
докт. биол. наук, ИНБИ РАН