Немногие органы отличаются таким внешним разнообразием, как фаллосы. У животных с внутренним оплодотворением гениталии эволюционируют быстро, их размер и форма даже у близких видов могут существенно различаться. Пожалуй, самые удивительные в этом отношении животные — птицы. У 3% видов фаллосы длинные, гибкие, разнообразной формы, зато у остальных 97% они сильно редуцированы или вообще отсутствуют. Самих самцов отсутствие внешних половых органов нисколько не беспокоит, а вот ученые много лет ломают голову над природой этого эволюционного казуса.
Ключ к разгадке нашли специалисты Медицинского института Говарда Хьюза и Университета Флориды (США) и английские ученые из Университета Рединга. Оказалось, что отсутствие фаллоса у представителей отряда курообразных связано с активацией клеточной гибели в половом бугорке на определенной стадии эмбрионального развития. Исследователи отмечают, что использовали в своей работе последние достижения филогенетики, репродуктивной экологии и сравнительной морфологии птиц, а также биологии развития гениталий млекопитающих.
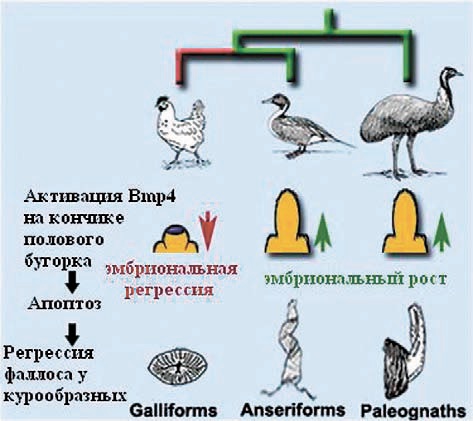
Эти достижения, в частности, позволяют проследить за тем, как птицы расставались с фаллосом. У самцов древних бескилевых птиц (Paleognathae) гениталии хорошо развиты, у представителей более молодого отряда гусеобразных (Anseriformes) — тоже, а у большинства видов сестринского отряда курообразных (Galliformes) от полового органа остался лишь рудимент на передней стенке клоаки. Самая эволюционно новая клада птиц, Neoaves, к которой относится большинство ныне живущих видов, обходится вообще без фаллоса.
Исследователи сравнили эмбриональное развитие гениталий у селезней пекинской утки Anas platyrhynchos, представителя отряда гусеобразных, и петухов домашней курицы Gallus gallus domesticus. Для сравнения в качестве внешней группы исследовали бескилевых птиц эму и ближайшего родственника птиц, аллигатора. У обоих видов закладка половых бугорков происходит на одном и том же этапе эмбрионального развития. Они развиваются сходным образом до определенной стадии, после которой формирование фаллоса у петухов прекращается и половой бугорок рассасывается, в то время как в эмбрионе селезней он продолжает расти.
Гены, регулирующие рост полового бугорка, известны. В обоих эмбрионах они работают одинаково и абсолютно нормально. Реакция клеток на сигналы ростовых факторов также не нарушена. Но на определенной стадии развития в петушиных эмбрионах начинается апоптоз клеток на кончике полового бугорка, как раз в то время, когда происходит его редукция.
Морфогенеза без апоптоза не бывает. В половом бугорке гусеобразных он идет, но не очень активно. У эму апоптоз клеток полового бугорка также слаб, а у эмбрионов аллигатора вообще еле заметен. А главное — ни у одного из названных видов апоптоз не затрагивает кончик бугорка. Исследователи заключили, что активный апоптоз клеток в этой области — эволюционное приобретение курообразных. Но что могло его вызвать?
Первый кандидат — семейство костных морфогенетических белков (bone morphogenetic proteins — Bmp). Свое название они получили, поскольку первоначально ученые обнаружили их способность воздействовать на формирование кости и хряща, хотя вообще эти белки регулируют морфогенез разных органов, в том числе полового бугорка (установлено на мышах).
Исследователи сравнили экспрессию генов Bmp2, Bmp4 и Bmp7 у эмбрионов селезня и петуха и обнаружили различия, возникающие на стадии, предшествующей регрессии будущего фаллоса. В эмбрионах селезня Bmp4 и Bmp7 экспрессируются только в клоаке и в основании полового бугорка, в петушиных — по всей его длине, включая кончик, т.е. экспрессия генов Bmp совпадает в пространстве и времени с волной гибели клеток полового бугорка.
Ученые заблокировали действие белка Bmp. Они насытили пористые акриловые шарики раствором белка Noggin, который связывает Bmp и блокирует его взаимодействие с рецепторами. Эти шарики диаметром 125-250 мкм наложили на одну сторону полового бугорка куриного эмбриона до того, как он начал рассасываться. Noggin блокировал апоптоз клеток в течение 24 часов, и та половина полового бугорка, на которой лежали шарики, продолжала расти. Разница в размерах получилась более чем шестикратная (100,8 мкм против 15,6 мкм). Шарики, пропитанные нейтральным буфером, на апоптоз не повлияли. А если положить на половой бугорок утиного эмбриона шарики, пропитанные, Bmp2 (аналогом Bmp4), они вызовут апоптоз и регрессию бугорка.
Исследователи пришли к заключению, что активность Bmp4 на кончике полового бугорка необходима и достаточна для апоптоза и регрессии фаллоса у курообразных. Эта активность возникла у них в ходе эволюции.
На вопрос о том, как птицы утратили фаллос, ученые ответили, но осталось непонятным, какие преимущества это дает самим птицам и почему сохранился этот странный признак. Об этом пока можно лишь гадать, хотя гипотезы, конечно, есть.
Одна из них основана на том, что копуляция с самцом, лишенным гениталий, невозможна без активного участия самки. Принудить ее к половому акту партнер не может. Птицы должны точно совместить отверстия клоак, и самка выворачивает влагалище. Таким образом она контролирует отцовство, т.е. потеря фаллоса способствует усилению роли самки в выборе полового партнера.
Согласно альтернативной точке зрения, редукция фаллоса — побочный результат при отборе другого признака. Гены, регулирующие развитие наружных половых органов, контролируют также образование
конечностей, кишечника, нервной системы, мышц и других структур. В частности, изменению активности генов Bmp в определенных тканях птицы обязаны также потерей зубов, разнообразием формы клюва и перьями. Кстати, зачатки зубов, а также первого и последнего пальцев развиваются у птичьих эмбрионов, но затем рассасываются, как и половой бугорок. Возможно, активность Bmp при формировании разных органов контролируют одни и те же генетические элементы. Но даже если редукция фаллоса — не цель отбора, а побочный его результат, дальнейшее сохранение этого признака требует постоянных стабилизирующих усилий.
Как подчеркивают авторы работы, генетический механизм формирования фаллоса у птиц не нарушен, поэтому теоретически он может из рудиментарного органа превратиться в функциональный. Для этого достаточно модуляции активности гена Bmp4. Возможно, именно это произошло с древесными курами Cracidae, обладателями вполне функционального фаллоса, хотя и не так хорошо развитого, как у гусеобразных.
Ученые намерены продолжать сравнительные исследования. В частности, их интересует, какой механизм привел к полной редукции фаллоса у Neoaves.
Herrera et al., Developmental Basis of Phallus Reduction during Bird Evolution, Current Biology (2013), http://dx.doi.org/10.1016/j. cub.2013.04.062