Негласный армейский устав:
Пункт № 1. Командир всегда прав.
Пункт № 2. Если командир не прав, смотри пункт № 1.
Существует мнение, что театр начинается с вешалки. Рассмотрение апелляций по результатам ЕГЭ по химии 27 июня 2014 года в Воронеже началось с того, что нас выгнали в тесное помещение между двумя входными дверьми. До этого мы находились в коридоре школы перед аудиторией, где должно было начаться рассмотрение апелляции.
Возможно, для облегчения тяжкого труда апелляционной комиссии, которая стремилась всеми силами не признать наши доказательства, нам запретили проносить и использовать любую литературу, содержащую доказательства наших доводов. Наивные выпускники для подтверждения своих доказательств принесли с собой учебники и научную литературу, веря, что ссылки на авторитеты им помогут. Оказалось зря!
И все это в ситуации, когда ознакомиться со своей работой было возможно только в момент ее рассмотрения. До этого момента получить ее не удалось. В центре РЦОИ всем отказались показывать работы. Видимо, боялись, что учащиеся смогут лучше подготовиться к апелляции, чем сама комиссия. Допуск же грамотных химиков, желающих помочь апеллянтам отстаивать свои интересы, был сильно затруднен. В качестве пропуска признавалась только нотариально заверенная доверенность от апеллянта и его родителя. Причем по личному устному заявлению самого совершеннолетнего апеллянта допуск его представителей осуществлялся по изменчивому желанию распорядителя.
В самой аудитории нас ждал еще один сюрприз. Председатель апелляционной комиссии заявила, что она не компетентна в химии и все свои аргументы мы можем высказывать членам федеральной предметной комиссии, которые, как оказалось, и проверяли эти работы после ЕГЭ. По закону все было соблюдено. Рассматривал работу на апелляции не тот эксперт предметной комиссии, который ее проверял, а его коллега. А, как известно, рука руку моет – обе чистые.
Основным аргументом членов этой комиссии являлось несоответствие решений апеллянтов «идеальному» решению, приведенному в «ключе», с претенциозным названием «Содержание верного ответа и указания по оцениванию». Правда в этом случае возникает вопрос: зачем в предметной комиссии, проверявшей работы после ЕГЭ нужны такие грамотные химики, как доктор химических наук, профессор, декан химического факультета ВГУ (председатель комиссии), другие доктора и кандидаты химических наук, преподаватели вузов? Сопоставить ответы с критериями, приведенными в «ключе» может любой грамотный выпускник школы. Может быть, члены предметной комиссии имеют такой высокий статус для того, чтобы дать «соответствующие разъяснения апеллянту»1?
Вот примеры таких разъяснений:
Задание «С2»: …Полученный раствор [по предыдущему контексту раствор FeCl3] нагрели и поместили в него порошок меди. При этом наблюдали изменение цвета раствора. Напишите уравнения четырех [это последнее] описанных реакций.
Ключ: 2FeCl3 + Cu = 2FeCl2 + CuCl2
Решение учащегося: FeCl3 + Cu = FeCl2 + CuCl
Разъяснение председателя предметной комиссии: В случае, указанном апеллянтом, в реакции выпадает осадок хлорида меди (I), а в условии задания о выпадении осадка ничего не сказано. Кроме того, основной цвет конечному раствору придает хлорид меди (II), а не хлорид меди (I) и хлорид железа (II).
Комментарий автора статьи: Обе эти реакции возможны. Первая – в случае недостатка меди, вторая – в случае ее избытка. Вторая реакция, записанная апеллянтом, является совокупностью двух процессов, идущих последовательно:
2FeCl3 + Cu =2FeCl2 + CuCl2
2CuCl2 + 2Cu =4CuCl
С практической точки зрения (а задание «С2» является практически- ориентированным), если мы поместим избыток медного порошка в подогретый раствор FeCl3, в итоге получится рыхлый осадок мало растворимой бесцветной соли CuCl. Разогрев раствора и измельчение меди, как это было указано в условии, значительно ускорит оба процесса. И запись верного уравнения реакции в случае избытка меди будет выглядеть как в решении апеллянта. Избыток же меди апеллянтом продемонстрирован коэффициентами в уравнении реакции.
Более того, с точки зрения логики и теории аргументации, уравнение реакции, записанное апеллянтом, полностью соответствует условию: цвет раствора изменился с желтого на светло-зеленый (раствор FeCl3 оранжево-желтый, раствор CuCl2 зеленый (в разбавленных растворах – голубой), раствор FeCl2 светло-зеленый, CuCl в осадке на цвет раствора не влияет). В условии не было указаний ни на соотношение реагентов (хлорида железа (III) и меди), ни на выпадение осадка, ни на серовато-зеленый цвет конечного раствора (при недостатке меди цвет раствора определяется смешением желтого цвета избыточного FeCl3 и зеленого CuCl2), ни на еще бесконечный ряд значительных и незначительных фактов. Более того, были указаны условия, значительно облегчающие получение хлорида CuCl (нагревание раствора и измельчение меди до порошка).
Кроме того, в таблице растворимости, которую выдают для использования во время ЕГЭ, сведения о растворимости соединений Cu+ нет вообще. И учащийся мог и не знать о низкой растворимости хлорида меди I.
Уравнение реакции, указанное в ключе, тоже верное, но реализуется при недостатке меди.
Итог: Апелляция не удовлетворена. Учащийся (призер Областной олимпиады по химии, занявший второе место), получил на 3 балла ниже по химии.
Еще один пример.
Задание «С3»:
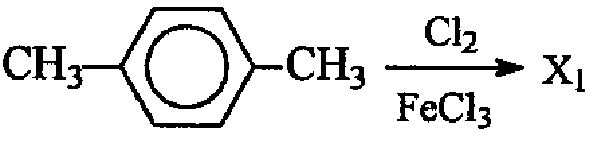
Ключ:
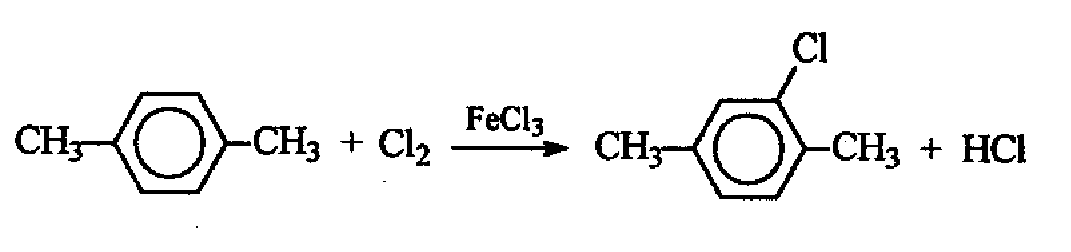
Решение учащегося:

Разъяснение члена предметной комиссии:
На странице 592 [учебник для студентов вузов «Органическая химия» Ю.С.Шабаров, часть 2, Москва, Химия, 1996] – введение первого атома галогена снижает электронную плотность в ядре и затрудняет введение второго атома галогена. В чем это выражается. Да в том, что если первый атом галогена входит в ядро при комнатной температуре, то для введения второго уже нужно 100 градусов [стр. 606]. Не спасает положение и введение алкильных заместителей. При комнатной температуре п-ксилол дает моно-галогенированное производное [стр. 607]. В задании ЕГЭ, кроме того, что четко указан один моль хлора без избытка, не стоит значка температуры. Хотя в тех случаях, когда это нужно, указан и избыток, и температура. Учебник Шабарова – это, конечно, «круто» даже для учеников, у которых 6 уроков химии в неделю, однако, и в банальном Егорове из раза в раз повторяется – при эквимольном соотношении образуется моногалогенированное производное.
Комментарий автора статьи:
По сути представленный на экзамене ответ не является противоречащим условию задания.
В учебнике Егорова А.С. «Химия. Пособие-репетитор для поступающих в вузы» однозначного указания на выход только моногалогенпроизводного нет. Более того, цитирую: «При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации» [стр. 546]. Там же: «метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью» [стр. 545]. Экстраполируя, учащийся легко может сделать вывод о еще большей реакционной способности диметилбензола (пара-ксилола) и о более высокой скорости реакции галогенирования, что приведет к заметному выходу дигалогенпроизводного даже в эквимолярном соотношении. И нет ни слова о нагревании. В задании же нет однозначного указания на соотношение реагентов 1:1. А если нет, то это значит, что учащийся волен трактовать это по своему усмотрению.
Теперь к научной литературе.
Учебник Шабарова Ю.С. не дает однозначного ответа.
Стр. 606: «для получения дибром и дихлорбензолов реакцию проводят при 100 °С в присутствии двух молей галогена». Процесс хлорирования кольца на некоторых своих стадиях гомогенный, на некоторых – гетерогенный (при пропускании газообразного хлора через раствор хлорида железа в пара – ксилоле). Задать соотношение количеств веществ на практике и количественно получить дигалоген или моногалогенпроизводное невозможно. Поэтому говорить о двух молях галогена в данном случае не очень корректно. Очевидно, что есть факторы в пользу увеличения доли дихлорпроизводного в серии продуктов:
- «С введением двух и более алкильных групп в бензольное ядро галогенирование последнего облегчается» (стр. 607). Что это не спасает положение, как заметил член предметной комиссии, здесь не сказано.
- Нагревание (с. 606) (не указано в задании – значит оставлено на усмотрение учащегося или вообще не важно и сложно учитывается для школьника).
- Использование более активного катализатора. «В присутствии таких активных катализаторов, как тригалогенид алюминия при ста градусах можно заместить на галоген все атомы водорода в бензольном ядре» (с. 606). И это в бензоле, где это сложнее чем в пара-ксилоле, и введение каждого последующего хлора все труднее и труднее. Более низкая активность указанного в условии катализатора вполне может быть компенсирована наличием двух алкильных заместителей. Силу влияния каждого из этих факторов учесть довольно трудно.
- Возможность дигалогенпроизводного продукта замещения подтверждается и учебником «Органическая химия» О.Я. Нейланда, рекомендованного для студентов химических специальностей вузов. (Данный учебник рекомендовался при изучении химии в 10 классе в качестве дополнительного учебного пособия преподавателем кафедры органической химии ВГУ Соловьевым А.С., который преподавал курс органической химии в нашей школе № 28 г Воронежа в 2012-2013 году).
- Цитата из этого учебника страница 238: «Прямое галогенирование является методом получения галогенаренов (за исключением фтораренов). Хлорирование происходит очень легко при взаимодействии арена с хлором в присутствии небольших количеств катализатора (Fe , FeCl3, другие кислоты Льюиса). При хлорировании бензола получают хлорбензол, дихлорбензол, трихлорбензол. Легко хлорируются толуол, ксилолы, бифенил, нафталин». В том же учебнике стр. 243 можно найти дополнительное подтверждение, указывающее на вполне заметный выход дихлорзамещенного продукта: «Реакции замещения характерны для галогенаренов. Известны обычные реакции электрофильного замещения: нитрования, сульфирования, галогенирования. Скорости реакции сравнимы со скоростями подобных реакций бензола». Это свидетельствует о незначительном снижении способности органической молекулы после замещения первого атома водорода в исходном пара-ксилоле на хлор (т.к. в тексте идет речь скорости реакции галогенирования уже галогенарена), и заметном выходе дихлорпроизводного.
Есть факторы и в пользу уменьшения доли дихлорпроизводного.
- Несогласованная ориентация алкильными группами, хотя после введения первого атома хлора ориентируют в пара-положение (относительно первого хлора) уже два заместителя.
- Пространственный фактор.
Я однозначно согласен, что дихлорпроизводного в реакционной смеси будет меньше, но не следовые количества даже при соотношении 1:1. Варьируя условия, можно добиться как значительного снижения, так и увеличения выхода дихлорпроизводного.
Если подойти к этому вопросу с точки зрения кинетики, то, естественно, скорость образования дихлорпродукта на начальном этапе равна 0, а при накоплении монохлорпродукта и нагревании вполне заметна и растет.
Ссылаться на коэффициенты в сложных органических реакциях и уравнивать их, с моей точки зрения, вообще грех.
Отсутствие над стрелкой слова избыток не является прямым указанием на соотношение исходных веществ 1:1. В «ключах» других вариантов, например, не указан избыток перманганата калия, хотя по коэффициентам его больше 1.
По поводу неосновного продукта реакции. Мы же зачитываем как верное уравнение реакции Вюрца (которое указано в ключе) с получением параксилола, хотя он точно не доминирующий продукт этой реакции. Почему нельзя было зачесть и получение дигалогенпроизводного? Уравнение реакции по своей идее не является неверным. Учащийся показал, что знает, как проходит галогенирование при наличии катализатора (в кольцо, а не на радикалы), и учел правила ориентации (второй хлор ориентируют и первый хлор, и метил), написав два хлора «напротив» друг друга, а не рядом с «первой» метильной группой. То есть он показал более высокий уровень знаний, чем от него требовалось.
Итог. Апелляция удовлетворена частично. Данное уравнение реакции не было признано экспертом в качестве верного, но последующие уравнения реакции были зачтены, т.к. «лишний» хлор в галогенарене практически не повлиял на ход остальных реакции. Во время проверки это сделано не было. Надо отдать должное смелости эксперта, который их признал верными, несмотря на несоответствие ключу.
Защищал апеллянта в данном случае автор этой статьи. Интересно, была бы удовлетворена апелляция, хотя бы частично, без часовой дискуссии между автором этой статьи и экспертом?
В этот же день не была удовлетворена апелляция учащегося, у которого в уравнении реакции (С1) коэффициенты представляли собой не набор наименьших целых чисел, а были увеличены в два раза (уравнение реакции было уравнено). В химии в настоящее время допустимы не только целые, но даже дробные коэффициенты. В методике преподавания химии делается особый акцент на то, что коэффициенты в уравнении реакции отражают только соотношение количеств веществ участников. Основное требование в записи химической реакции состоит в том, что количества веществ, расходуемых в ходе реакции, а также количества выделяющихся продуктов должны относиться друг к другу так, как относятся стехиометрические коэффициенты. Соответственно, вполне допустимы даже отрицательные, а также дробные и целые (как наименьшие, так и не наименьшие) числа в качестве коэффициентов. (Исключение делается только при рассмотрении отдельных стадий реакций, где коэффициенты должны отражать числа молекул, вступающих в элементарный акт химической реакции.)
Применительно к данному случаю, задания «С1 следует заметить, что числа, получающиеся в электронном балансе, НЕ являются коэффициентами, это – множители, показывающие соотношение частиц окислителя и восстановителя.
Я не являюсь противником ЕГЭ. Сами задания и предлагаемые в качестве ключей варианты решений, которые мне удалось увидеть в этом году, с моей точки зрения, вполне корректны. Но мне кажется, что такая компетентная предметная комиссия как раз и создана для того, чтобы учитывать нестандартные, но верные решения учащихся, и не на апелляции, а во время первичной проверки.
К сожалению, как мне кажется, эксперты не справились со своей задачей. И поведение членов предметной комиссии при рассмотрении апелляций совсем не удивительно. Мотив вполне понятен. Они защищали свой авторитет. А большинство, как известно, не любят признавать своих ошибок. Авторитет свой они, в глазах вышестоящих чиновников, сохранили. Но цена этому – полная потеря авторитета среди талантливых учащихся, которые получили очередной урок взрослой жизни: у сильного всегда бессильный виноват.
Дмитрий Николаевич Турчен,
кандидат химических наук