Про технологию CRISPR/Cas — эдакие универсальные геномные ножницы — в последние годы сказано очень много. Эта технология действительно произвела революцию и позволила существенно расширить возможности молекулярной биологии. Метод позволил без особых усилий редактировать в лаборатории практически любую ДНК: разрезать ее в нужных местах и при надобности заменять отдельные участки на другие, получая на выходе генетически модифицированный организм с заданными свойствами.
По идее, эта технология могла бы помочь в будущем не только создавать ГМО животных и растений, но и помочь людям с генетическими заболеваниями. Попытки уже ведутся, но результаты пока не опубликованы. Методика была опробована на пациентах с серповидно-клеточной анемией, бета-талассемией и раком пищевода; кроме того, известно о единственном случае редактирования человеческих эмбрионов (в Китае). Этот случай вызвал волну негодования и споров в научных кругах: эксперимент был поставлен «на коленке» и — судя по обрывкам просочившейся информации — не удался.
Технология CRISPR/Cas далека от совершенства. Метод не всегда срабатывает правильно, и особенно часто сбои происходят в человеческих клетках. Эксперименты на клеточных линиях говорят о том, что правильное редактирование происходит лишь в 3–20% случаев.
Основные проблемы начинаются на стадии «зашивания» ДНК. CRISPR/Cas без труда удается сделать разрез в заданном месте, но дальше метод полагается на то, что клетка сама этот разрез «залатает» по образцу, предоставленному учеными. В зависимости от характера разреза клетка использует разные системы починки, отличающиеся по аккуратности. CRISPR/Cas разрезает обе нити ДНК, и за подобные починки отвечает самая неряшливая система репарации.

Два года назад команда исследователей под руководством биохимика Дэвида Лю (David Liu), зав. лабораторией в частном научно-исследовательском Институте Броада (Кембридж, штат Массачусетс) и профессора Гарвардского университета, придумали вариант CRISPR/Cas, который позволяет не резать обе цепочки ДНК, а надрезать одну из двух и самостоятельно чинить этот надрез. Основной фермент, который проводил все операции, состоял из двух кусков: вместе оказались сшиты мутантный белок Cas9, способный разрезать одну цепь ДНК в нужном месте, и фермент, аккуратно модифицирующий «буквы» ДНК. К сожалению, у нового способа было явное ограничение — он мог заменить всего одну «букву» ДНК-кода, а более крупные изменения оказались невозможны.
Недавно авторы этого метода выпустили статью [1], в которой предложили усовершенствованную версию метода: теперь стало возможным аккуратно менять любое количество «букв» подряд. Хитрость заключается в использовании нового гибридного фермента. Как и в предыдущем случае, одна из его половинок состоит из мутантного белка Cas9. Вторая часть состоит из обратной транскриптазы — фермента, который умеет синтезировать ДНК по матрице РНК.
Всю работу нового редактора можно разбить на несколько ступеней (рис. 1).

- Геномный редактор находит нужный участок ДНК и делает надрез в заданной точке.
- С одной стороны надреза происходит наращивание цепи «правильной» последовательностью.
- Старый кусок ДНК вытесняется новой последовательностью.
- На второй цепи ДНК — до этого нетронутой (интактной) — делается надрез напротив измененного куска.
- Клеточная система починки ДНК распознает его и чинит по образцу уже исправленной цепи.
Для работы нового редактора требуется не только фермент — машинка для резки и синтеза ДНК, — но и лекало, по образцу которого будут проводиться эти изменения. В его роли выступает единая молекула РНК, содержащая последовательности, комплементарные исходной и требуемой последовательности, а также участок, который связывается с ферментом. Для классической системы CRISPR/Cas тоже нужны образцы последовательностей исходника и результата, но там они устроены немного по-другому и лежат на разных молекулах.
За счет своей похожести РНК может находить участок ДНК, который нужно изменить и связываться с ним, образуя комплекс РНК-ДНК. В таком виде ее находит фермент, связывается и делает надрез в ДНК.
Ферменты синтеза ДНК не умеют делать ее «просто так», для работы им требуются хвост уже существующей молекулы, который они смогут достраивать, и образец — комплементарная цепь. Свободный хвост ДНК появляется из-за надреза, а в качестве образца фермент использует кусок РНК с внесенными изменениями. Таким образом, от последовательности молекулы РНК целиком зависит то, где и какие изменения будут сделаны, а фермент является универсальным исполнителем.
Важно, что и лекало, и фермент изначально расположены близко к редактируемому участку, оперативно включаются в синтез и контролируют его. Это снижает вероятность вмешательства других случайных клеточных ферментов и увеличивает предсказуемость результата.
В итоге работы гибридного фермента редактируемый кусок выглядит следующим образом. Одна цепь по-прежнему остается нетронутой, а вторая надрезана и достроена так, что у изменяемого куска есть две версии — старая и новая. Они частично совпадают, так что комплементарная цепь может взаимодействовать с обеими.
Следующая задача исследователей — сделать так, чтобы интродуцированный кусок последовательности закрепился в ДНК: вытеснил старую последовательность на той же цепи и изменил под себя вторую комплементарную цепь. Частично решение этих задач возложено на собственные ресурсы клетки, но всё равно не пускается на самотек, а держится под контролем.
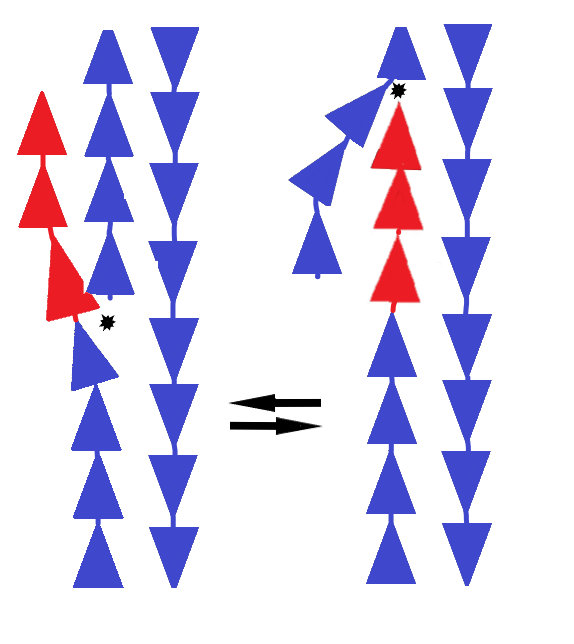
Системы починки ДНК видят одноцепочечный разрыв ДНК и стремятся его починить, но у них есть два варианта действий (отмечены звездочками на рис. 2): с восстановлением искомой последовательности (на рисунке слева) или с добавлением новой (справа). В сторону новой последовательности клетку быстро склоняет фермент под названием эндонуклеаза FEN1, которая охотится за свободно болтающимися хвостами ДНК и разрушает их. Нить ДНК имеет направление, и эндонуклеаза умеет откусывать только с одного ее конца. Расчет ученых сделан на то, что этим концом окажется старый участок ДНК. После того как старый кусок ДНК был съеден эндонуклеазой, у клеточной системы починки не остается выбора — и она зашивает разрыв с включением новой последовательности.
Второй шаг — исправление комплементарной цепи — тоже проходит при помощи клеточных систем починки ДНК под контролем исследователей. Новый участок ДНК не полностью комплементарен второй цепи, и клетка пытается это тоже исправить. Перед ней встает новый выбор: какую из цепей взять за образец — отредактированную или нетронутую? Для того чтобы ввести клетку в заблуждение и заставить ее исправить цепь с исходным кодом, ученые идут на хитрость. При помощи того же мутантного фермента Cas9 и образца РНК они делают новый надрез, на этот раз в нетронутой цепи. Это кардинально влияет на клеточный выбор: она расценивает этот надрез как источник ошибки и исправляет его по примеру целой цепи — с уже отредактированным участком.
Несмотря на внешнюю сложность манипуляций, этот метод — по словам его авторов — гораздо аккуратнее и эффективнее предыдущего: в зависимости от клеточных линий, на которых проверяли метод, и от размера вставки количество удачно отредактированных участков варьировало от 20 до 50%, а количество ошибок колебалось в пределах 10%.
Авторы исследования проверили новый метод на разных типах вставок. Всего они провели более 175 «операций» по исправлению геномов клеточных линий, среди которых были как однобуквенные, так и более крупные вставки, замены и удаления в пределах нескольких десятков букв. По их словам, данным методом можно исправить примерно 89% всех известных вариантов ДНК, связанных с генетическими заболеваниями.
Конечно, новому методу еще предстоит всесторонняя проверка другими исследовательскими группами, но уже сейчас он выглядит очень перспективно. В отличие обычного CRISPR/Cas он по минимуму использует клеточные системы починки, а если и пользуется ими, то берет только аккуратные и контролирует их работу.
Вера Мухина,
сотр. УНЦ «Биоинформатика» ИППИ РАН
- Anzalone A. V., Randolph P. B., Davis J. R. et al. Search-and-replace genome editing without double-strand breaks or donor DNA // Nature. 2019.