Кислород — один из важнейших элементов на Земле. Появившись изначально как токсичный отход жизнедеятельности фотосинтезирующих микроорганизмов, сейчас свободный кислород составляет порядка 20% атмосферы нашей планеты. За годы своего существования жизнь на Земле приспособилась к кислородной атмосфере, и теперь большинство эукариотических организмов использует кислород, чтобы получать энергию в процессе дыхания. Нобелевскую премию по физиологии и медицине за 2019 год получили Грегг Семенза (Gregg L. Semenza), сэр Питер Рэтклифф (Sir Peter J. Ratcliffe) и Уильям Кэлин (William G. Kaelin Jr) за фундаментальные работы, раскрывающие детали того, как эукариотические клетки воспринимают кислород из окружающей среды и адаптируются к его уровню.
Для бактерий и митохондрий кислород — важное конечное звено в системе белковых электрических «проводов», которые ученые называют электрон-транспортной цепью. Эта цепь используется для окисления молекул пищи до углекислого газа, а выделяющаяся в процессе энергия используется организмом. Кислород при этом принимает на себя отнятые у углерода электроны и в таком виде входит в состав воды. Без него электроны из пищи могут запускать самые разные спонтанные химические реакции в клетке и приводить к ее гибели. Потому критически важно, чтобы любая «дышащая»1 клетка организма постоянно имела доступ к этому элементу в достаточных количествах.

Человеческий организм очень чутко реагирует на количество кислорода. Если в крови его по тем или иным причинам становится недостаточно, почки начинают выделять гормон эритропоэтин, который заставляет костный мозг произвести больше эритроцитов — клеток, переносящих кислород от легких к тканям через кровь. Первый среди лауреатов этого года, Грегг Семенза, хотел разобраться, как устроена система синтеза эритропоэтина в клетках почек.
Первый вопрос, на который нужно было ответить, — что является транскрипционным фактором гена эритропоэтина. Транскрипционными факторами называют белки, которые запускают работу того или иного гена. Как правило, неподалеку от гена на хромосоме находится область посадки для таких белков. И если найти ген, как правило, очень легко, то обнаружить область посадки его транскрипционного фактора — задача менее тривиальная. Семенза использовал генетически модифицированных мышей, которым случайным образом менял тот участок хромосомы, в котором ожидал найти участок посадки фактора. В какой-то момент он нашел этот участок, а также сумел определить белок, который выполняет роль транскрипционного фактора. Этот ранее неизвестный белок он назвал «индуцируемым гипоксией фактором», или HIF-1α.

Семенза и параллельно работавший над той же темой сэр Питер Рэтклифф обнаружили, что HIF-1α экспрессируется не только в почках, но и практически во всех тканях организма. Этот транскрипционный фактор запускал, например, рост новых сосудов при разрушении старых. При снижении уровня кислорода в окружающей среде количество HIF-1α начинало расти. А что приводило к этому росту, было неясно.
Ответ на этот важный вопрос пришел из неожиданного места. Онколог Уильям Кэлин занимался исследованием болезни Гиппеля — Линдау (VHL). При этом состоянии у пациентов нарушается рост сосудов, а также часто возникают опухоли, в частности, в почках. Кэлин обнаружил, что заболевание вызывается мутациями в гене VHL, который в нормальном состоянии подавляет опухолевый рост. Он изучил клетки с нарушенным геном VHL и показал, что в них присутствует сильно увеличенное количество HIF-1α, к тому же не зависящее от уровня кислорода. Внедрение нормального гена VHL в раковые клетки восстанавливало концентрацию HIF-1α до нормальных значений.

Продукт гена VHL оказался убиквитин-лигазой. Тут стоит отдельно пояснить, что такое белковые модификации. Белки в клетках выполняют практически все задачи — от восприятия окружения до химических превращений. И клетке необходимо иметь возможность этими белками управлять. В ходе эволюции появилось множество различных вариантов такого контроля, одним из которых является оперативное изменение структуры и формы белковой молекулы путем присоединения к ней различных довесков. Они могут иметь самую разную химическую природу — от относительно простых соединений вроде фосфорной кислоты до больших белковых или углеводных молекул. Модификации белков могут «выключать» или «включать» их работу, заставлять их перемещаться в нужную часть клетки и так далее.
Белки класса убиквитин-лигаз занимаются тем, что модифицируют другие белки убиквитином. Транспортные белки распознают убиквитиновые цепочки и отправляют помеченный ими белок на деградацию, тем самым снижая его концентрацию. Кэлин обнаружил, что исследуемый им белок VHL обладал способностью убиквитинилировать HIF-1α и тем самым снижать его количество в клетке. Причем его активность возрастала в присутствии кислорода. При гипоксии VHL переставал убиквитинилировать HIF-1α, и клетка переключалась на новый режим работы. Мутации гена VHL приводили к нарушению этой функции, и HIF-1α продолжал присутствовать в клетке даже когда в нем отпадала необходимость.
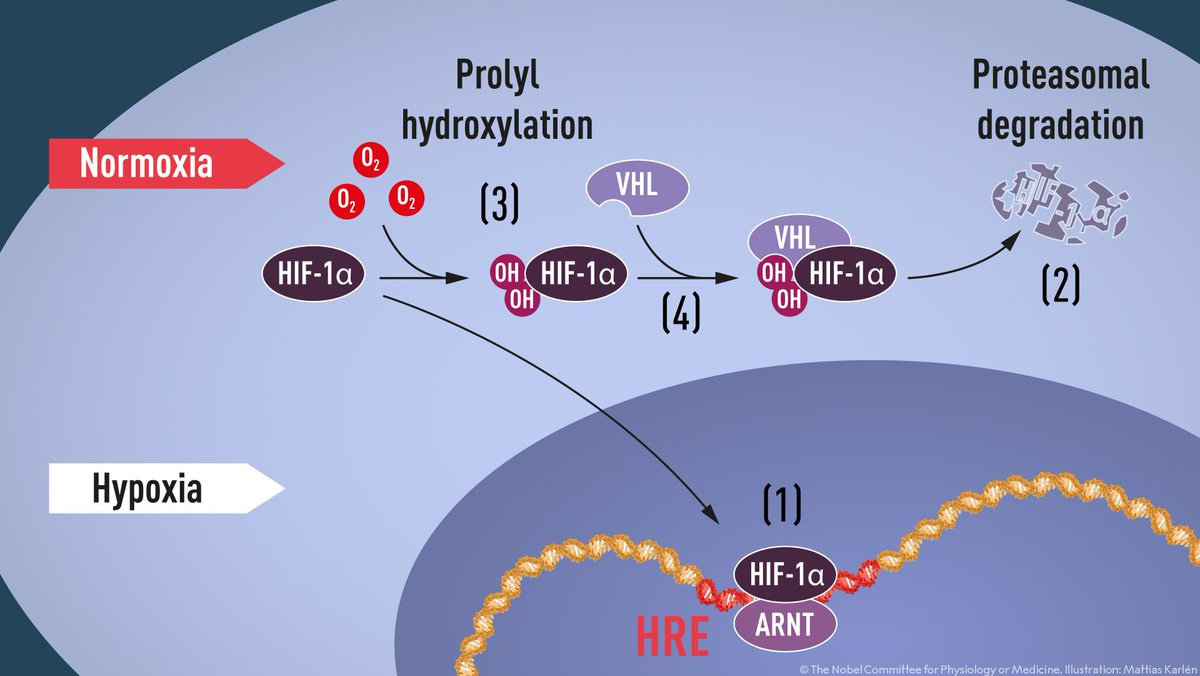
Когда этот факт вскрылся, многое встало на свои места. Но была еще одна область, в которой не всё было понятно. Как именно белок VHL «чувствовал» кислород? Объединенными усилиями Рэтклифф и Кэлин сумели ответить и на этот вопрос. Оказалось, что в белке VHL регуляция работы происходила при помощи ранее неизвестной модификации — пролин-гидроксилирования. Ответственные за эту модификацию ферменты пролил-гидроксилазы содержат в своем составе ион железа. Подобно гемоглобину, они способны связывать кислород с железом и в таком виде активироваться. Активированная пролил-гидроксилаза вносит модификации в структуру VHL, который начинает снижать концентрацию HIF-1α. В последующие годы было обнаружено множество подобных пролил-гидроксилаз.
Так за что же дали Нобелевскую премию в этом году? Почему это открытие оказалось столь важным, что Нобелевский комитет счел его достойным награды? На это можно дать несколько ответов. Во-первых, были раскрыты детали универсального механизма, который присутствует почти во всех клетках. Во-вторых, быстро оказалось, что на этот механизм завязано множество различных заболеваний, как онкологической, так и другой природы. А понимание механизма — это уже половина пути к лечению. Ну и, наконец, был раскрыт новый механизм белковой модификации, неизвестный ранее. А это уже полноценное фундаментальное открытие. Так что исследователи совершенно точно наработали на своего заслуженного Нобеля.
Максим Казарновский
1 Некоторые клетки, например красные клетки крови, не имеют митохондрий и не получают энергию путем дыхания. Это не позволяет им эффективно использовать питательные вещества, но их метаболизм этого и не требует. Много ли потребностей у клетки, которая просто течет с потоком крови и не нуждается ни в движении, ни в активном синтезе белков?